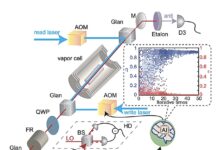
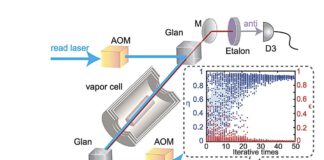
Stellen Sie sich einen Computer vor, der nicht aus Siliziumchips besteht, sondern aus interagierenden Enzymen – den biologischen Katalysatoren, die die chemischen Prozesse des Lebens antreiben. Das ist keine Science-Fiction; Forscher der Radboud-Universität in den Niederlanden haben ein solches Gerät entwickelt. Im Gegensatz zu herkömmlichen Computern, die auf starrer Programmierung basieren, passt sich dieser „chemische Computer“ an und lernt durch die dynamischen Wechselwirkungen seiner molekularen Komponenten und bietet einen Einblick in eine Zukunft, in der Berechnungen mit Biologie verschmelzen.
Seit Jahrzehnten versuchen Wissenschaftler, die bemerkenswerte Anpassungsfähigkeit lebender Systeme in künstlichen Geräten nachzubilden. Zellen nehmen Nährstoffe, Hormone und Temperaturveränderungen mühelos wahr und passen ihr Verhalten entsprechend an. Die Nachahmung dieser Komplexität in nichtbiologischen Systemen hat sich als Herausforderung erwiesen. Die meisten Versuche, „chemische Computer“ zu bauen, waren entweder zu einfach oder zu unflexibel, um das differenzierte Zusammenspiel biologischer Netzwerke zu erfassen.
Dieser neue Ansatz geht einen anderen Weg. Anstatt jeden chemischen Schritt akribisch zu programmieren, haben die Forscher ein System zusammengestellt, bei dem sich sieben verschiedene Enzyme auf winzigen Hydrogelkügelchen befinden, die in einem Röhrchen verpackt sind. Als Input für den Computer dient eine fließende Flüssigkeit, die kurze Aminosäureketten (Peptide) trägt. Wenn diese Peptide auf die Enzyme treffen, versucht jedes Enzym, sie an bestimmten Stellen zu spalten.
Dies ist jedoch kein linearer Prozess. Der Schnitt eines Enzyms verändert die Form des Peptids und die verfügbaren Schnittstellen für nachfolgende Enzyme, wodurch ein Kaskadeneffekt entsteht. Dieser komplizierte Tanz chemischer Reaktionen erzeugt ständig wechselnde Muster im System. Diese Muster werden zur Sprache, mit deren Hilfe der Computer Informationen interpretiert.
„Wir können uns die Enzyme als Hardware und die Peptide als Software vorstellen“, erklärt Dongyang Li, ein Forscher am California Institute of Technology, der nicht an der Studie beteiligt war. „Dieses System löst je nach Input neue Probleme.“
Bemerkenswerterweise weist dieses dynamische System Eigenschaften auf, die an das biologische Gedächtnis erinnern. Da chemische Reaktionen unterschiedlich schnell ablaufen, speichert das Netzwerk Spuren früherer Signale und kann so Muster erkennen, die sich im Laufe der Zeit entwickeln. Es kann beispielsweise zwischen schnellen und langsamen Lichtimpulsen unterscheiden und demonstriert damit seine Fähigkeit, Veränderungen zu verfolgen, anstatt einfach auf statische Eingaben zu reagieren.
Dieser „chemische Computer“ ist nicht an die Einschränkungen herkömmlicher Schaltkreise gebunden. Es erkennt Temperaturschwankungen und klassifiziert sie mit bemerkenswerter Genauigkeit (durchschnittlich 1,3 °C Fehler bei 25 °C bis 55 °C), kann sogar pH-Werte erkennen und auf Lichtimpulsrhythmen reagieren. All dies wird erreicht, ohne dass eine Neuverkabelung oder Neukonstruktion der wichtigsten chemischen Komponenten erforderlich ist.
Das Team war von der Effizienz des Systems angesichts seiner bescheidenen Größe verblüfft. Das Potenzial für eine Skalierung ist enorm. Der Forscher Wilhelm Huck stellt sich eine Zukunft vor, in der komplexere Systeme, die Dutzende oder sogar Hunderte von Enzymen umfassen, optische oder elektrische Signale direkt in chemische umwandeln könnten, wodurch sie auf völlig neue Weise mit biologischen Systemen interagieren könnten.
Diese bahnbrechende Arbeit stellt einen bedeutenden Schritt zur Überbrückung der Lücke zwischen künstlicher und biologischer Berechnung dar. Es öffnet Türen zu innovativen Anwendungen, von hochgradig anpassungsfähigen Sensoren bis hin zu biokompatiblen Schnittstellen, die Technologie nahtlos in lebende Organismen integrieren.