Старение – неотъемлемая часть жизни, но когда оно переходит в патологию, приводя к нейродегенеративным заболеваниям, как болезнь Альцгеймера, Паркинсона или боковой амиотрофический склероз, это становится настоящей угрозой для человеческого разума. Молекулярные механизмы, связывающие этот естественный процесс с разрушением нервных клеток, оставались до недавнего времени загадкой. Но японские ученые из Токийского медицинского и стоматологического университета (TMDU), возглавляемые профессором Хитоши Окадзавой, провели исследование, которое проливает свет на эту тайну, сосредоточившись на роли единственного ядрышкового белка – PQBP3.
PQBP3: Белок-Ключ к Ядерной Стабильности
Более двадцати лет назад команда профессора Окадзавы открыла семейство белков PQBP, играющих важную роль в связывании с болезнетворными белками при полиглутаминовых заболеваниях, таких как болезнь Хантингтона. В ходе нового исследования, опубликованного в журнале EMBO, исследователи обратили внимание на PQBP3 и его необычное поведение во время клеточного старения.
- Из ядрышка в цитоплазму: Оказалось, что PQBP3, обычно обитающий по периферии ядрышка, словно покидает свой «дом» и перемещается в нуклеоплазму или цитоплазматический слой во время старения клетки. Это перемещение сопровождается утечкой ядерной ДНК в цитоплазму – словно нарушается граница между ядром и остальной частью клетки.
- Дестабилизация Ядерной Мембраны: Электронная микроскопия показала, что структура самой ядерной мембраны становится хрупкой и неустойчивой в клетках, где PQBP3 покинул ядрышко. Это как будто бы ослабление защитного барьера, ограждающего генетический материал.
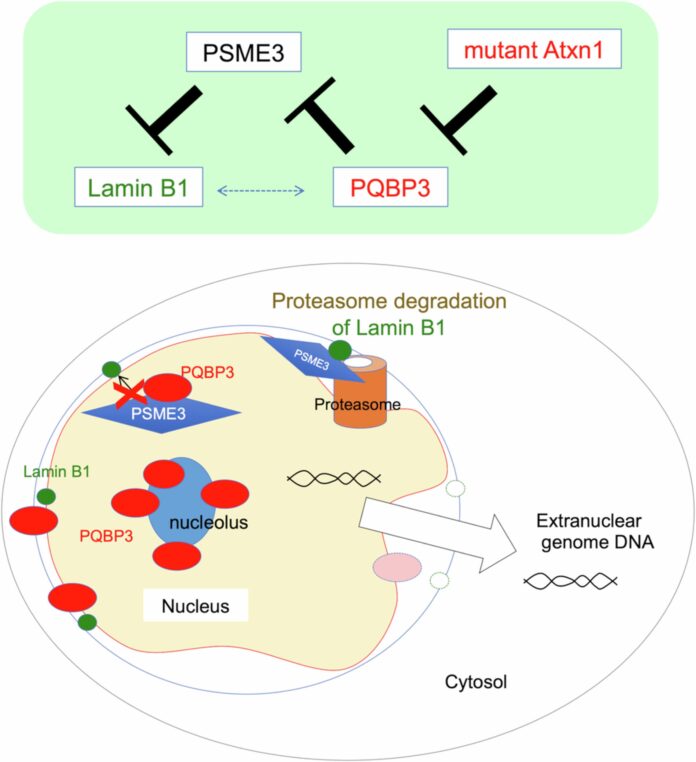
Чтобы понять причину этой дестабилизации, ученые применили биоинформатику и базы данных о взаимодействии белков. Выяснилось, что PQBP3 связывается с белком PSME3, ключевым участником процесса разрушения других белков (протеасома).
PQBP3: Посредник Между Старением и Нейродегенерацией
В здоровых клетках PQBP3 частично перемещается на ядерную мембрану и связывается с PSME3, тем самым подавляя разрушение ламина В1 – белка, составляющего основу ядерной оболочки. Однако в стареющих клетках этот процесс замедляется, и ламин В1 разрушается быстрее, что приводит к ослаблению ядерной мембраны.
Но связь PQBP3 с нейродегенерацией не ограничивается лишь старением клеток. Исследователи провели эксперименты на моделях спиноцеребеллярной атаксии 1-го типа (SCA1), полиглутаминовой болезни, характерной для образования аномальных белковых агрегатов (телец включения). В этих моделях PQBP3 «захватывается» этими тельцами, что снижает его концентрацию в ядрышке и нарушает его функцию, в конечном итоге приводя к дестабилизации ядерной мембраны.
PQBP3: Двуликий Герой или Противоречивый Механизм?
Открытия команды Окадзавы открывают новую главу в понимании взаимосвязи старения и нейродегенерации. PQBP3, как оказалось, может быть ключевой мишенью для новых терапевтических подходов, направленных на замедление старения мозга и борьбу с нейродегенеративными заболеваниями.
“Поскольку потеря функции PQBP3 наблюдается как при клеточном старении, так и при нейродегенерации в нейронах головного мозга, нацеливание на PQBP3 теоретически может позволить предотвратить как старение мозга, так и нейродегенерацию”– отмечает профессор Окадзава.Однако, важно отметить, что PQBP3 играет сложную роль в клетках, отличных от нейронов. В этих клетках его снижение может быть фактором риска развития рака, поскольку старение клеток естественным образом подавляет онкологические процессы. Таким образом, PQBP3 оказывается «двуликим героем», связанным с фундаментальной биологической дилеммой – противостоянием клеточных патологий, рака и нейродегенерации.
Исследование команды Окадзавы открывает новые горизонты в борьбе с возрастными заболеваниями мозга. Понимание молекулярных механизмов, управляемых PQBP3, может привести к разработке эффективных стратегий для замедления старения и защиты нервной системы от необратимых повреждений.